Lớp 2 - liên kết tri thức
Lớp 2 - Chân trời sáng tạo
Lớp 2 - Cánh diều
Tài liệu tham khảo
Lớp 3Sách giáo khoa
Tài liệu tham khảo
Sách VNEN
Lớp 4Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Lớp 5Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Lớp 6Lớp 6 - kết nối tri thức
Lớp 6 - Chân trời sáng sủa tạo
Lớp 6 - Cánh diều
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 7Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 8Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 9Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 10Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 11Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 12Sách giáo khoa
Sách/Vở bài bác tập
Đề thi
Chuyên đề & Trắc nghiệm
ITNgữ pháp giờ đồng hồ Anh
Lập trình Java
Phát triển web
Lập trình C, C++, Python
Cơ sở dữ liệu

Các dạng bài bác tập hóa học lớp 9Chương 1: các loại hợp chất vô cơChương 2: Kim loạiChương 3: Phi kim. Qua quýt về bảng tuần hoàn các nguyên tố hóa họcChương 4: Hiđrocacbon. Nhiên liệuChương 5: Dẫn xuất của Hiđrocacbon. Polime
Để học xuất sắc Hóa học lớp 9, phần bên dưới tổng hợp triết lý và bài xích tập trắc nghiệm (có đáp án) hóa học lớp 9 Chương 1: các loại hợp chất vô cơ. Bạn vào tên dạng hoặc Xem chi tiết để xem những chuyên đề hóa học 9 tương ứng.
Bạn đang xem: Ôn tập hóa học 9 chương 1 các loại hợp chất vô cơ
Mục lục Hóa 9 Chương 1: các loại hợp hóa học vô cơ
I. Kim chỉ nan & Trắc nghiệm theo bài xích học
II. Những dạng bài bác tập
Cách viết phương trình hóa học
1. Phản nghịch ứng hoá học
Phản ứng hoá học: là quá trình biến hóa chất này thành chất khác.
2. Phương trình hoá học
Phương trình hoá học: màn trình diễn ngắn gọn phản ứng hoá học.
◊ 3 bước lập phương trình hoá học:
- B1: Viết sơ vật dụng của phản bội ứng (CTHH của chất phản ứng và sản phẩm).
VD: Viết sơ trang bị phản ứng: H2 + O2 → H2O
- B2: cân đối số nguyên tử từng nguyên tố: search hệ số tương thích đặt trước các công thức.
VD: cân bằng số nguyên tử của từng nguyên tố: Thấy vế phải có 1 nguyên tố oxi, vế trái tất cả 2 nhân tố oxi → Thêm thông số 2 trước H2O để 2 vế cùng có 2 yếu tố oxi. Tiếp theo sau cân thông qua số nguyên tố hidro ở cả hai vế bằng phương pháp thêm hệ số 2 vào trước H2.
- B3: Viết phương trình hoá học.
VD: Viết phương trình hoá học
2H2 + O2 → 2H2O
Chú ý:
Ở B2, hay sử dụng cách thức “Bội chung bé dại nhất” để tại vị hệ số bởi cách:
♦ lựa chọn nguyên tố bao gồm số nguyên tử ở hai vế chưa đều nhau và có số nguyên tử những nhất (cũng gồm trường hợp chưa phải vậy).
♦ tra cứu bội chung bé dại nhất của những chỉ số nguyên tử nguyên tố đó ở hai vế, lấy bội chung nhỏ nhất phân tách cho chỉ số thì ta có hệ số.
♦ Trong quy trình cân bởi không được biến hóa các chỉ số nguyên tử trong các công thức hóa học.
Bài tập vận dụng
Bài 1: Viết các phương trình hoá học tập biểu diễn những phản ứng hoá học ở những thí nghiệm sau:
a) Nhỏ vài giọt axit clohiđric vào đá vôi.
b) Hoà tan canxi oxit vào nước.
c) Nhúng một thanh fe vào dung dịch đồng(II) sunfat.
Hướng dẫn:
a) 2HCl + CaCO3 → CaCl2 + H2O + CO2.
b) CaO + H2O → Ca(OH)2.
Xem thêm: Bản Đồ Chỉ Đường Thành Phố Hồ Chí Minh, Ho Chi Minh City
c) fe + CuSO4 → FeSO4 + Cu.
Bài 2: bao hàm bazơ sau: Fe(OH)3, Ca(OH)2, KOH, Mg(OH)2. Hãy cho thấy thêm những bazơ nào:
a) Bị nhiệt phân huỷ?
b) Tác dụng được với hỗn hợp H2SO4?
Hướng dẫn:
a) Bazơ bị nhiệt phân huỷ: Fe(OH)3, Mg(OH)2
b) công dụng được cùng với dd H2SO4: Fe(OH)3, Ca(OH)2, KOH, Mg(OH)2.
Cách giải bài xích tập Oxit bazơ tính năng với axit
Lý thuyết và phương thức giải
Oxit bazơ + axit → muối bột + nước
VD: FeO + H2SO4 → FeSO4 + H2O
CuO + HCl → CuCl2 + H2O
Phương pháp giải bài xích tập oxit bazơ chức năng với axit:
- bước 1: Viết PTHH.
- bước 2: thống kê giám sát theo PTPU (có thể để ẩn).
- cách 3: đo lường và tính toán theo yêu ước của đề bài.
Bài tập vận dụng
Bài 1: đến 4,48g oxit bazơ CaO chức năng vừa đầy đủ với axit H2SO4. Sau khoản thời gian cô cạn sản phẩm, thu được từng nào gam muối bột khan?
Hướng dẫn:
- cách 1: Viết PTHH
CaO + H2SO4 → CaSO4 + H2O
- cách 2: đo lường và tính toán theo PTPU
Theo phương trình bội nghịch ứng: nCaO = nCaSO4
Theo đề bài:
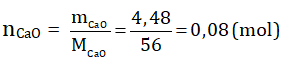
⇒ nCaSO4 = 0,08 (mol)
- bước 3: giám sát theo yêu ước của đề bài
Vậy mmuối khan = mCaSO4 = 0,08.136 = 10,88 (gam)
Bài 2: Hòa tan trọn vẹn 2,81 gam láo lếu hợp tất cả Fe2O3, MgO, ZnO trong 500 ml H2SO4 0,1 M (vừa đủ). Sau bội phản ứng, các thành phần hỗn hợp muối sunfat khan thu được khi cô cạn dung dịch có trọng lượng là bao nhiêu?
Hướng dẫn:
♦ cách 1 (Áp dụng định phép tắc bảo toàn khối lượng)
- cách 1: Viết PTHH
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O (1)
MgO + H2SO4 → MgSO4 + H2O (2)
ZnO + H2SO4 → ZnSO4 + H2O (3)
- cách 2+3: tính toán theo PTPU với tính hiệu quả theo yêu cầu của đề bài
tự 3 PTHH trên, ta thấy nH2SO4 = nH2O = 0,1.0,5 =0,05 (mol)
Theo định luật bảo toàn khối lượng, ta có:
moxit + mH2SO4 = mmuối + mH2O
⇒ mmuối =(moxit + mH2SO4) - mH2O= (2,81 + 0,05.98) – 0,05.18 = 6,81 g
Vậy trọng lượng muối khan nhận được sau làm phản ứng là 6,81 g
♦ bí quyết 2 (Phương pháp tăng sút khối lượng)
Áp dụng tăng sút khối lượng, ta thấy 1 O được thay thế sửa chữa bởi 1 team SO4:
Fe2O3 → Fe2(SO4)3
MgO → MgSO4
ZnO → ZnSO4
⇒ 1 mol oxit tăng 96-16 = 80 g
⇒ khối lượng muối sau phản ứng là:
mmuối = moxit + nH2SO4 . 80 =2,81 + 0,1.0,5.80 = 6,81 g
Nhận xét:
-Trong phản ứng của oxit bazơ tính năng với axit H2SO4 thì nH2SO4 = nH2O
⇒ Tương tự, trong bội nghịch ứng của oxit bazơ tính năng với axit HCl thì nHCl = 2.nH2O
VD: Fe2O3 + 6HCl → 2FeCl3 + 3H2O
-Trong vấn đề oxit bazơ chức năng với axit ta hoàn toàn có thể áp dụng phương pháp bảo toàn khối lượng.
moxit + maxit = mmuối + mnước
-Trong bài toán oxit bazơ tác dụng với axit ta có thể áp dụng cách thức tăng sút khối lượng.
⇒ cùng với axit H2SO4, ta bao gồm công thức: mmuối = moxit + 80. NH2SO4
⇒ cùng với axit HCl, ta bao gồm công thức: mmuối clorua = moxit + 27,5.nHCl
Bài 3: Hòa tan hoàn toàn 2,8 gam láo hợp gồm Fe2O3, MgO, CuO đề xuất dùng 200 ml HCl 0,5M. Tất cả hổn hợp muối clorua khan thu được khi cô cạn dd có cân nặng là bao nhiêu?
Hướng dẫn:
♦ cách 1 (Áp dụng định điều khoản bảo toàn khối lượng)
Ta biết nHCl = 2.nH2O = 0,5.0,2 = 0,1 (mol)
⇒ nH2O = 0,05 (mol)
Áp dụng định lao lý bảo toàn trọng lượng ta có:
moxit + maxit clohiđric = mmuối clorua + mnước
mmuối clorua = (moxit + maxit clohiđric) - mnước
mmuối clorua = (2,8 + 0,1.36,5) - 0,05.18 = 5,55 g
Vậy khối lượng muối khan chiếm được là 5,55 g.
♦ giải pháp 2 (Phương pháp tăng bớt khối lượng)
Ta có: nHCl = 0,2.0,5 = 0,1 mol.
Áp dụng công thức
mmuối clorua = moxit + 27,5.nHCl
mmuối clorua = 2,8 + 27,5.0,1 = 5,55 g
Cách giải bài bác tập Oxit axit tác dụng với bazo
Lý thuyết và cách thức giải
TH1: Khi oxit axit (CO2, SO2…) tính năng với hỗn hợp kiềm (KOH, NaOH…)
PTHH:
CO2 + NaOH → NaHCO3 (1)
CO2 + 2NaOH → Na2CO3 + H2O (2)
Phương pháp giải
Bước 1: Xét tỉ lệ: .
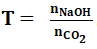
- trường hợp T ≤ 1 thì sản phẩm thu được là muối hạt axit ⇒ Chỉ xảy ra phản ứng (1)
- giả dụ 1 2, SO2…) công dụng với dung dịch kiềm thổ (Ca(OH)2, Ba(OH)2…)
PTHH:
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
Phương pháp giải
Bước 1: Xét tỉ lệ: .
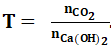
-Nếu T ≤ 1 thì thành phầm thu được là muối trung hòa ⇒ Chỉ xảy ra phản ứng (1)
-Nếu 1 3 cùng hấp thụ trọn vẹn khí CO2 có mặt vào 0,5 lit hỗn hợp NaOH 0,56 M .Tính mật độ mol của muối thu được. (thể tích chuyển đổi không đáng kể)
Hướng dẫn:
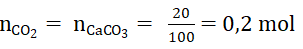
nNaOH = 0,56 . 0.5 = 0,28 mol
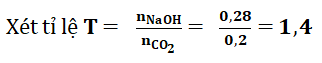
Do 1 2 + NaOH → NaHCO3 (1)
x x x
CO2 + 2NaOH → Na2CO3 + H2O (2)
y 2y
Đặt số mol CO2 bội phản ứng làm việc PT (1), (2) theo thứ tự là x với y mol.
Ta có hệ phương trình:
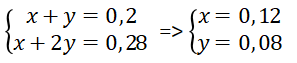
⇒CM(NaHCO3)= 0,12:0,5 = 0,24 M
Bài 2: Sục thanh nhàn V lít khí SO2 sinh hoạt đktc vào 100 ml hỗn hợp Ba(OH)2 1,5M, nhận được 23,3 gam kết tủa. Tính giá trị của V.
Hướng dẫn:
Ta có: nBa(OH)2 = 0,15 mol; nBaSO3 = 0,1 mol.
Vì n↓ Ba(OH)2 cần kết tủa chưa cực đại ⇒ Có các trường phù hợp sau:
- Trường hợp 1: Ba(OH)2 dư ⇒ muối sinh sản thành chỉ tất cả BaSO3
PTHH:SO2 + Ba(OH)2 → BaSO3 + H2O
0,1 0,1(mol)
⇒ VSO2 = 0,1 x 22,4 = 2,24 lít
- Trường đúng theo 2: SO2 hết dẫu vậy đã hòa tan một trong những phần kết tủa.
PTHH:SO2 + Ba(OH)2 → BaSO3 + H2O (1)
0,15 0,15 0,15(mol)
Theo (1) thì nBaSO3 = 0,15mol, mà lại theo đề thì nBaSO3 = 0,1mol ⇒ nBaSO3 bị hòa tan: 0,15 – 0,05 = 0,1 mol















